Biochimie
- Antiradicalaire (ORAC)
- Dosage des phénols totaux
- Inhibiteurs: collagénase, élastase
- Peroxydation lipidique
- Quantification d'ADN (Hoechst)
- Quantification d'ATP
Biologie Cellulaire
- Activité métabolique (Résazurine)
- Antioxydant cellulaire et ORAC
- Perméabilisation membranaire
- Potentiel antibiotique
- Potentiel antifongique
- Potentiel antiviral
- Potentiel anti-inflammatoire
- Potentiel antimutagène
- Potentiel anticancéreux
- Potentiel hémolytique
- Production d'anion superoxyde
- Production d'Interleukines
Biologie Moléculaire
 Vous trouverez sur la gauche la liste des différents services que notre laboratoire est actuellement en mesure de vous offrir.
Vous pouvez en tout temps cacher et réafficher la liste en cliquant sur la petite double flèche qui se trouve au dessus de la liste.
En cliquant sur les liens de la liste, une brève description de chaque méthode vous sera fournie.
Des liens à l'intérieur des descriptions sont aussi disponibles pour vous offrir le plus d'informations pertinentes possible.
Survolez les mots colorés pour afficher des images ou obtenir de l'information supplémentaire.
Si un test que vous désirez n'est pas disponible dans la liste, il est possible de faire la mise au point de nouveaux.
Vous trouverez sur la gauche la liste des différents services que notre laboratoire est actuellement en mesure de vous offrir.
Vous pouvez en tout temps cacher et réafficher la liste en cliquant sur la petite double flèche qui se trouve au dessus de la liste.
En cliquant sur les liens de la liste, une brève description de chaque méthode vous sera fournie.
Des liens à l'intérieur des descriptions sont aussi disponibles pour vous offrir le plus d'informations pertinentes possible.
Survolez les mots colorés pour afficher des images ou obtenir de l'information supplémentaire.
Si un test que vous désirez n'est pas disponible dans la liste, il est possible de faire la mise au point de nouveaux. Pour plus de renseignements concernant la marche à suivre pour faire affaire avec notre laboratoire vous pouvez communiquer avec Dr Jean Legault, directeur du laboratoire.
Biochimie
Phénoliques totaux

Les composés phénoliques sont souvent de puissants antioxydants et il peut être d'intérêt de les doser pour évaluer leur contribution lorsqu'un extrait par exemple montre un potentiel antioxydant. Notre test est fondé sur une méthodologie élaborée dans les années 60 pour doser les composés phénoliques dans le vin. Ce test strictement chimique (n'impliquant pas de cellules vivantes) consiste à faire réagir l'échantillon avec un réactif commercial appelé le Folin-Ciocalteu pour ensuite effectuer une mesure colorimétrique au lecteur de plaques (Varioskan ) qui nous permet de rapporter la concentration phénolique de l'échantillon sur une courbe standard de composés phénoliques connus (typiquement l'acide tannique ou l'acide gallique). Ce test ne se prête malheureusement pas à tous les échantillons parce qu'il peut être affecté par les sucres réducteurs ainsi que les protéines.
Le dosage phénolique est souvent réalisé en parallèle avec le test ORAC et le test de potentiel antioxydant cellulaire.
Quantification d'ADN au Hoechst

Le Hoechst est une molécule qui devient fluorescente lorsqu'elle se lie à de l'ADN. Une quantification d'ADN est effectuée systématiquement après le test d'activité métabolique à la résazurine lors des tests de potentiel anticancéreux (cytotoxique). Aussi, il est possible d'effectuer un dosage d'ADN à la fin d'autres tests, comme le test de potentiel antioxydant cellulaire par exemple.
Biologie Cellulaire
Mesure de l'activité métabolique à la Résazurine

La résazurine (7-Hydroxy-3H-phenoxazin-3-one 10-oxide) est une molécule bleue non fluorescente qui peut être réduite par l'activité métabolique (mitochondriale ou bactérienne) pour être transformée en résorufine rose fluorescente. Une mesure de l'activité métabolique à la résazurine est effectuée lors de chaque test de potentiel anticancéreux (cytotoxicité) ainsi que lors des test de potentiel anti-inflammatoire sur les macrophages de souris.
Antioxydant cellulaire et ORAC

Ces deux tests permettent de détecter et de quantifier certaines propriétés antioxydantes des échantillons testés. Le test ORAC est un simple test chimique largement utilisé pour évaluer le potentiel antioxydant. Plus spécifiquement, il peut détecter les antioxydants capables d’éliminer les radicaux peroxyls, mais de par sa nature strictement chimique, ce test ne peut rendre état d’un potentiel dans un contexte cellulaire vivant. Le test sur cellules ne permet pas de discriminer les différents modes d’action des composés testés, mais est sensible à une plus large gamme d’antioxydant, comme par exemple les chélateurs de fer, indétectables par le test ORAC. De plus, le test cellulaire permet la détection de potentiel pro-oxydants qui ne sont pas non plus détectables par le test ORAC. Aussi, le test sur cellule peut renseigner sur la toxicité à court termes des composés testés en réalisant une quantification d’ADN par le Hoescht sur les cellules encore vivantes à la fin du test. Des fibroblastes cutanés sains ( WS-1 ) sont utilisés par défaut pour le test de potentiel antioxydant cellulaire, mais d'autres lignées cellulaires peuvent être utilisées au besoin selon le contexte d'étude.
Les deux tests de potentiel antioxydant se déroulent en microplaques et sont réalisés à l'aide du lecteur de plaque (Fluoroskan ). Les tests sur cellules sont réalisés en microplaques à 96 puits tandis que les tests ORAC sont réalisés en microplaques à 384 puits. Tous les tests antioxydants sont contrôlés en testant en parallèle une variété d’antioxydants connus, comme la quercetine, l’acide caféique, la catéchine, le Trolox, le deferoxamine ou d’autres au besoin. Le test sur cellules renvoie la concentration nécessaire à inhiber 50% de l’oxydation (IC50), tandis que le test ORAC renvoie un équivalent Trolox (µmol Trolox / mg d'échantillon testé).
Le dosage des phénols totaux est souvent réalisé en parallèle avec les tests de potentiel antioxydant lorsque les échantillons testés sont des extraits ou des mélanges complexes.
Publication de notre méthode cellulaire pour évaluer le potentiel antioxydant.
Notre publication rapportant le potentiel antioxydant du sirop d'érable
Potentiel Antibiotique (bactéricides & bactériostatiques)
Notre test antibactérien consiste à cultiver diverses bactéries avec les échantillons et à mesurer l’absorbance développée dans le temps pour ainsi quantifier leur croissance et déterminer une concentration minimale inhibitrice (CMI) ou une concentration minimale bactéricide (CMB). Deux incubations et deux lectures d'absorbance peuvent être nécessaires pour discriminer les bactéricides des bactériostatiques. Tous nos tests de potentiel antibactériens sont réalisés en microplaques à 96 puits et nécessitent un lecteur de plaques capable de mesurer l'absorbance (Varioskan ). Chaque activité antibactérienne est comparée à l'activité de certains antibiotiques utilisés en clinique, comme la gentamycine.
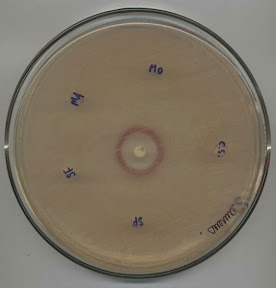
Il est aussi possible de faire un test antibactérien sur disque. Ce test consiste à mettre l'échantillon testé sur un disque de papier buvard que l'on dépose sur une gélose inoculée de la bactérie. Un disque contrôle avec un antibiotique connu est aussi utilisé. Après l'incubation, la mesure du halo autour du disque est effectuée à l’aide d’un vernier.
Nous disposons d'une vaste banque de bactéries qui peuvent être utilisées pour réaliser les tests de potentiel antibactérien. De plus, notre laboratoire étant de confinement niveau 2, nous avons la possibilité de travailler avec des bactéries résistantes aux antibiotiques conventionnels (comme les SARM), provenant directement du milieu hospitalier.
Exemple d'une publication que nous avons réalisée avec les tests de potentiel antibiotiquePhytotherapy Research. 2006 May;20(5):371-3.
Composition and antibacterial activity of Abies balsamea essential oil.
André Pichette, Pierre-Luc Larouche, Maxime Lebrun, Jean Legault.
Antifongique
Notre test antifongique consiste a mettre la levure Candida albicans en contact avec l'échantillon testé et à mesurer l'absorbance développée dans le temps pour ainsi quantifier leur croissance et déterminer une concentration active. Chaque activité antifongique est comparée à un antifongique connu: l'amphotéricine B.
En résumé, les échantillons à différentes concentrations sont mis en plaque avec les levures. Les plaques sont incubées, après quoi l'absorbance de chaque puit est lue au lecteur de plaques (Varioskan ).
Antiviral
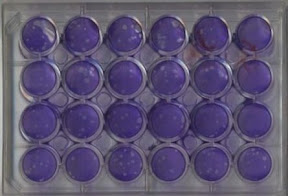
Notre test antiviral consiste à incuber les virus dans différentes conditions avec les échantillons à tester. Pour l'instant, nous avons la possibilité de tester les échantillons sur deux types de virus, l'herpes simplex type 1 et influenza. Chaque activité antivirale est comparée à des antiviraux connus et utilisés en clinique, le tamiflu et l'acyclovir.
En résumé, les échantillons à différentes concentrations sont mis en plaque avec les virus. S'il s'agit du virus de l'herpes simplex de type 1, les plaques sont colorées et les plages de lyse sont ensuite comptées. S'il s'agit du virus de l'influenza, les plaques sont traitées à la résazurine pour mesurer l'activité métabolique des cellules hôtes et leur fluorescence est mesurée au lecteur de plaques (Varioskan ).
Anti-inflammatoire

Notre test anti-inflammatoire consiste à mesurer l’inhibition de la production d’oxyde nitrique (NO) produit par des macrophages de souris (RAW 264.7). Chaque activité anti-inflammatoire est contrôlé en comparaison avec un inhbiteur de l'iNOS, le L-name.
Brièvement, notre test consiste à mettre en plaque des macrophages de souris et de les incuber avec les échantillons à différentes concentrations. Du LPS (ou de l'interféron gamma) est ajouté dans les plaques pour provoquer une réaction inflammatoire chez les macrophages et stimuler la production de NO. Après incubation, les surnageants sont recueillis et mis en contact avec un réactif de dosage qui change de couleur en présence de NO (réactif de Griess). Une mesure de l'absorbance de chaque puits est effectuée au lecteur de plaque (Varioskan ). Les plaques vides de leur surnageant sont utilisées pour faire un test d'activité métabolique à la résazurine. Les lectures de fluorescence sont prises au lecteur de plaque (Fluoroskan ).
Potentiel Anticancéreux (cytostatiques & cytotoxiques)

Notre test de potentiel anticancéreux mesure la cytotoxicité des échantillons testés sur une variété de lignées cellulaires cancéreuses (comme A549 et DLD-1 ). L'expérimentation se déroule en deux temps. D'abord, les cellules sont exposées aux échantillons après quoi on mesure leur activité métabolique par le test de réduction de la résazurine. Ensuite, les surnageants sont retirés des plaques pour réaliser un dosage d'ADN par le Hoechst sur les tapis cellulaire toujours présents au fonds des puits et préalablement lysés. Ces deux étapes fondées sur deux méthodes différentes réduisent ensemble les possibilités de faux positifs et de faux négatifs en nous renseignant sur deux aspects attendus d'un anticancéreux. Comme il importe que les anticancéreux ciblent préférentiellement les cellules cancéreuses sans affecter les cellules saines, nous évaluons parallèlement leur sélectivité en mesurant la toxicité des échantillons sur une ou plusieurs lignées cellulaires non cancéreuses (comme WS-1 ). Aussi, chaque test est contrôlé en comparant l'activité de l'échantillon à des anticancéreux connus, comme l'étoposide et le fluorouracile.
Tous les tests de potentiel anticancéreux (cytotoxique) sont réalisés en microplaques à 96 puits et nécessitent un lecteur de fluorescence capable de lire des microplaques ( Fluoroskan ). Chaque expérience évalue l'activité de l'échantillon à plusieurs concentrations et résulte en une IC50. L'état des cellules est aussi observé au microscope (et photographié lorsque nécessaire) après la mesure de l'activité métabolique.
Exemple d'une publication que nous avons réalisée avec le test de potentiel anticancéreuxMolecules. 2008 Nov 26;13(12):2925-34.
Cytotoxic steroidal saponins from the flowers of Allium leucanthum.
Lasha Mskhiladze, Jean Legault, Serge Lavoie, Vakhtang Mshvildadze, Jumber Kuchukhidze, Riad Elias, André Pichette.
Potentiel Hémolytique

L'hémolyse est la libération de l'hémoglobine des globules rouges suite à une destruction de ces derniers ou à la perméabilisation de leur membrane cellulaire. L'hémolyse est un effet indésirable qu'on cherche à éviter lorsqu'on administre une molécule à un animal ou à un être humain, d'où l'intérêt de tester le potentiel hémolytique de toutes molécules à potentiel thérapeutique lors de leur développement pré-clinique.
Le test de potentiel hémolytique consiste à mettre des globules rouges (du sang) en présence du composé testé durant une certaine période de temps, ensuite de centrifuger le milieu de test (tubes ou microplaques) pour séparer les globules rouges (encore intègres ou rompus) du plasma sanguin dans lequel se trouve l'hémoglobine libre si des globules rouges ont été endommagés. La quantité d'hémoglobine libérée et par extension la proportion de globules rouges affectés peuvent être déterminées par une mesure d'absorbance avec le lecteur de plaques ( Varioskan ). Chaque test de potentiel hémolytique est contrôlé par du sang sans agent hémolytique et du sang complètement hémolysé par un agent hémolytique connu, comme par exemple des saponines. Le test de potentiel hémolytique résulte en une concentration hémolytique à 50%, c'est-à-dire la concentration nécessaire pour provoquer la libération de 50% de l'hémoglobine.
Exemple de publication que nous avons réalisée avec le test de potentiel hémolytiqueBioorganic and Medicinal Chemistry. 2009 Mar 1;17(5):2002-8. Epub 2009 Jan 15.
Haemolytic activity, cytotoxicity and membrane cell permeabilization of semi-synthetic and natural lupane- and oleanane-type saponins.
Charles Gauthier, Jean Legault, Karl Girard-Lalancette, Vakhtang Mshvildadze, André Pichette.
Biologie Moléculaire
Immunobuvardage de type Western
L'immunobuvardage de type Western (Western blot) est une mesure semi-quantitative de l'expression des protéines.
Cette technique peut nous informer sur:
- l'activation de voies de signalisation cellulaires (phosphorylation de voies spécifiques),
- l'induction de marqueurs apoptotiques (clivage de la PARP, activation des caspases et libération de cytochrome c) ou
- la modification de l'expression de protéines cibles (récepteurs ou facteurs de transcription).
- l'extraction des protéines totales, cytoplasmiques ou nucléaires;
- la séparation électrophorétique des protéines sur un gel d'acrylamide;
- leur transfert sur une membrane de PVDF et
- l'immunobuvardage de la membrane avec l'anticorps spécifique à la protéine choisie.
Expression de l'ARN messager par PCR

L'étude de l'expression de certaines protéines est parfois complexe lorsqu'elles sont modifiées post-transcriptionnellement ou que les anticorps disponibles sont peu spécifiques. Dans ce cas, nous pouvons étudier l'expression de l'ARN par PCR (réaction en chaîne par polymérase). Tout d'abord, l'ARN est extrait des cellules puis transcrit en ADN complémentaire par la transcription inverse (RT). Ensuite, les amorces spécifiques se lient à l'ADN complémentaire et l'ADN est amplifié lorsqu'il est exprimé. L'ADN amplifié migre sur un gel d'agarose et nous pouvons quantifier densitométriquement différents paramètres comme l'expression de récepteurs dans nos lignées cellulaires.
Fragmentation de l'ADN
La mort cellulaire programmée (apoptose) est caractérisée par une augmentation de la fragmentation de l'ADN. Notre laboratoire peut extraire l'ADN de cellules traitées et le faire migrer sur un gel d'agarose. Cette technique nous informe rapidement sur le type de mortalité cellulaire.
Caractérisation de mécanismes d'action cellulaires
Afin d'évaluer le mécanisme moléculaire de certaines molécules, il peut être utile d'activer ou d'inhiber différentes voies de signalisation cellulaire. Notre laboratoire possède plusieurs agonistes ou antagonistes spécifiques qui peuvent nous donner des indices sur les cibles moléculaires de certains produits. Par exemple, l'ajout d'un antagoniste peut inhiber l'effet anticancéreux d'un échantillon mesuré par le test métabolique (RRT) ou la quantification de l'ADN (Hoechst).